- 上海中申國際貿易有限公司,20年外貿進出口代理服務經驗。
- 服務熱線:139 1787 2118
醫療器械出口到馬來西亞需要滿足一些特定的認證和要求。以下是醫療器械出口馬來西亞所需的認證和注意事項:
一、醫療器械立法及主管
馬來西亞的醫療器械管理法是《醫療器械管理法(2012)》,該法規的基本框架比較接近美國的醫療器械管理法規。醫療器械的管理部門包括衛生部醫療器械管理局(Medical Device Authority,MDA)和科學技術部原子能許可證局。衛生部醫療器械管理局負責管理除放射性醫療器械和二手醫療器械外的所有醫療器械,而原子能許可證局負責管理放射性醫療器械和二手醫療器械。
二、馬來西亞進口醫療器械市場準入流程
(1)馬來西亞醫療器械的定義及分類
醫療器械被定義為具備以下用途的任意或聯合使用的儀器、器械、器具、機器、植入物、體外試劑或校準器、軟件、材料等。它們可以用于診斷、預防、監測、治療、減輕疾病及損傷,對解剖學或生理過程的研究,支持或維持生命,對器械的消毒,以及通過對取自人體的標本進行體外檢查,為醫療或診斷目的提供信息。然而,如果通過藥物、免疫等過程發揮這些功能,則不能被定義為醫療器械。根據馬來西亞醫療器械管理法規,醫療器械按風險從低到高分為A類、B類、C類和D類四類。其中,A類醫療器械風險最低,B類和C類居中,D類風險最高。
A類產品:低風險,如細胞計數儀。
B類產品:中低風險,如尿液分析儀。
C類產品:中高風險,如心電圖儀。
D類產品:高風險,如血液透析機。
(2)體外診斷試劑的分類及注冊
體外診斷試劑(in-vitro diagnostic,IVD)是指僅或主要用來為人體提供診斷、監測信息而單獨或組合使用的裝置,包括試劑、校準器、樣品容器等。根據醫療器械管理法,IVD產品根據對個人及公眾健康風險影響程度的高低分為A、B、C、D四類。各類別的風險程度和產品舉例如下:

對于IVD的注冊,需要遵循醫療器械管理法中的專門適用準則,并按照相應的步驟進行注冊。

三、馬來西亞進口醫療器械注冊流程
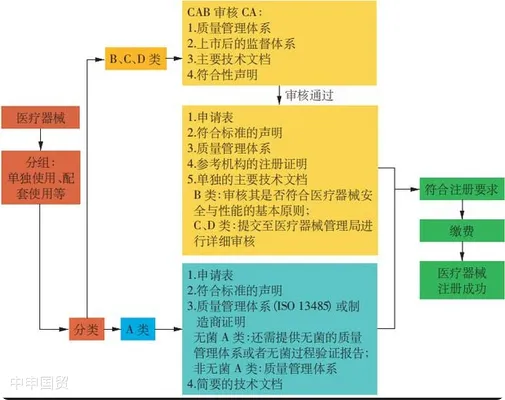
(1)A類產品
對于A類產品,當地的醫療器械授權代表(Authorized Representative,AR)可以向衛生部醫療器械管理局申請注冊,無需MDA授權的合格評定機構(Conformity Assessment Body,CAB)批準。申請人需要提交制造商的ISO 13485證書、測試報告以及標簽等文件。
(2)B、C、D類產品
對于B、C、D類產品,當地的醫療器械授權代表需要提交技術報告,并由合格評定機構進行技術文件審查。已經在參考國(如澳大利亞、加拿大、歐盟、日本、美國)獲得批準和銷售的醫療器械可以通過簡化程序進行審核。在審核過程中,需要向合格評定機構提交ISO證書、CE證書等文件。審核通過后,合格評定機構將頒發證書。最終的器械注冊文件,包括通用提交檔案模板(Common Submission Dossier Template,CSDT)、合格評定機構證書和申請文件,將以電子方式在線提交給衛生部醫療器械管理局進行審查和最終批準。合格評定機構的證書和器械注冊證書均應每5年更新一次。
四、注意事項
在醫療器械出口到馬來西亞的過程中,需要注意以下事項:
(1)目前馬來西亞注冊已不再需要自由銷售證書(Free Sales Certificate,FSC)。
(2)必須在馬來西亞指定的當地代表處提交注冊申請。
(3)每個產品只能有一個產品許可證持有人(即持證人)。
(4)產品許可證可以轉讓給其他持有人。
(5)所有制造商需要獲得ISO 13485認證,作為申請注冊的必備條件。
總結而言,醫療器械出口到馬來西亞需要滿足醫療器械管理法規定的注冊要求。具體流程包括分類確定、技術文件審查和提交、合格評定機構認證以及最終的在線注冊審批。在申請注冊之前,應仔細了解相關法規和要求,并確保符合馬來西亞的醫療器械出口標準。
相關推薦
聯系我們
郵箱:service@sh-zhongshen.com
相關推薦
微信聯系

? 2025. All Rights Reserved. 滬ICP備2023007705號-2  滬公網安備31011502009912號
滬公網安備31011502009912號